SEMAKAN MINI
Pos luar menentang kanser: penanda kanser sejagat sahaja
Chengchen Qian1, Xiaolong Zou2, Wei Li1,3, Yinshan Li4, Wenqiang Yu5
1Shanghai Epiprobe Biotechnology Co., Ltd, Shanghai 200233, China;2 Jabatan Pembedahan Am, Hospital Gabungan Pertama Universiti Perubatan Harbin, Harbin 150001, China;3Shandong Epiprobe Medical Laboratory Co., Ltd, Heze 274108, China;4 Hospital Rakyat Wilayah Autonomi Ningxia Hui, Universiti Perubatan Ningxia, Yinchuan 750002, China;5Pusat Klinik Kesihatan Awam Shanghai & Jabatan Pembedahan Am, Hospital Huashan & Institut Metastasis Kanser & Makmal Epigenetik RNA, Institut Sains Bioperubatan, Kolej Perubatan Shanghai, Universiti Fudan, Shanghai 200032, China
ABSTRAK
Kanser adalah penyebab utama kematian di seluruh dunia.Pengesanan awal kanser boleh mengurangkan kematian semua jenis kanser;bagaimanapun, biomarker pengesanan awal yang berkesan kurang untuk kebanyakan jenis kanser.Metilasi DNA sentiasa menjadi sasaran utama yang diminati kerana metilasi DNA biasanya berlaku sebelum perubahan genetik lain yang boleh dikesan.Semasa menyiasat ciri umum kanser menggunakan penjujukan kedudukan panduan baru untuk metilasi DNA, satu siri penanda kanser universal (UCOM) telah muncul sebagai calon yang kuat untuk pengesanan awal kanser yang berkesan dan tepat.Walaupun nilai klinikal biomarker kanser semasa dikurangkan oleh kepekaan yang rendah dan/atau kekhususan yang rendah, ciri unik UCOM memastikan hasil yang bermakna secara klinikal.Pengesahan potensi klinikal UCOM dalam kanser paru-paru, serviks, endometrium dan urothelial seterusnya menyokong penggunaan UCOM dalam pelbagai jenis kanser dan pelbagai senario klinikal.Malah, aplikasi UCOM kini sedang dalam siasatan aktif dengan penilaian lanjut dalam pengesanan awal kanser, diagnosis tambahan, keberkesanan rawatan dan pemantauan berulang.Mekanisme molekul di mana UCOM mengesan kanser adalah topik penting seterusnya untuk disiasat.Aplikasi UCOM dalam senario dunia sebenar juga memerlukan pelaksanaan dan penghalusan.
KATA KUNCI
Pengesanan kanser;pemeriksaan kanser;metilasi DNA;epigenetik kanser;biomarker kanser
Mengapa kami memerlukan yang baru dengan segera penanda bio?
Selepas memerangi kanser selama lebih satu abad, kanser masih merupakan ancaman biologi yang paling mematikan kepada manusia.Kanser kekal sebagai kebimbangan kesihatan global dengan 19.3 juta kes baharu dan hampir 10 juta kematian dianggarkan pada 20201. Pada tahun 2020, dianggarkan 4.6 juta kes baharu kanser telah didiagnosis di China, menyumbang 23.7% daripada kes kanser baharu di seluruh dunia menurut GLOBOCAN1.Tambahan pula, kira-kira 3 juta kematian dikaitkan dengan kanser di China pada tahun 2020, iaitu 30% daripada kematian berkaitan kanser global1.Statistik ini menunjukkan bahawa China menduduki tempat pertama dalam insiden dan kadar kematian kanser.Selain itu, kadar survival kanser 5 tahun ialah 40.5%, iaitu 1.5 kali lebih rendah daripada kadar survival 5 tahun di Amerika Syarikat2,3.Kelangsungan hidup yang lebih rendah dan kadar kematian yang lebih tinggi di China berbanding negara yang mempunyai indeks pembangunan manusia yang lebih tinggi menunjukkan bahawa sistem pencegahan dan pengawasan kanser yang cekap dan kos efektif diperlukan segera.Pengesanan awal kanser adalah salah satu elemen paling kritikal dalam sistem penjagaan kesihatan.Pengesanan awal kanser boleh meningkatkan prognosis dan kelangsungan hidup pada peringkat awal dalam hampir semua jenis kanser4.Strategi saringan yang berjaya telah menyebabkan penurunan ketara dalam insiden dan kadar kematian kanser serviks, payudara, kolorektal dan prostat.
Untuk mencapai pengesanan awal kanser, bagaimanapun, bukanlah satu tugas yang mudah.Menyiasat biologi dan prognosis kanser awal, mengenal pasti dan mengesahkan penanda bio pengesanan awal yang boleh dipercayai, dan membangunkan teknologi pengesanan awal yang boleh diakses dan tepat sentiasa menjadi halangan terbesar dalam proses4.Pengesanan tepat kanser boleh membezakan lesi benigna daripada malignan, yang membantu mengelakkan prosedur yang tidak perlu dan memudahkan pengurusan penyakit selanjutnya.Strategi pengesanan awal semasa termasuk biopsi berasaskan endoskopi, pengimejan perubatan, sitologi, immunoassay dan ujian biomarker5-7.Menjadi mengganggu dan mahal, biopsi berasaskan endoskopi membawa beban yang sememangnya berat sebagai prosedur perubatan utama yang bergantung kepada kakitangan profesional.Seperti sitologi, kedua-dua kaedah saringan bergantung kepada profesional perubatan dan berdasarkan pertimbangan peribadi dengan prestasi yang jauh dari ideal8.Sebaliknya, immunoassays sangat tidak tepat, memandangkan kadar positif palsu yang tinggi.Pengimejan perubatan, sebagai taktik saringan, memerlukan peralatan mahal dan juruteknik khusus.Oleh itu, pengimejan perubatan sangat terhad kerana kebolehcapaian yang rendah.Atas semua sebab ini, biomarker nampaknya merupakan pilihan yang lebih baik untuk pengesanan awal kanser.
Surat-menyurat kepada: Yinshan Li dan Wenqiang Yu
Email: liyinshan@nxrmyy.com and wenqiangyu@fudan.edu.cn
ID ORCID: https://orcid.org/0009-0005-3340-6802 dan
https://orcid.org/0000-0001-9920-1133
Diterima pada 22 Ogos 2023;diterima pada 12 Oktober 2023;
diterbitkan dalam talian pada 28 November 2023.
Boleh didapati di www.cancerbiomed.org
©2023 Biologi & Perubatan Kanser.Creative Commons
Atribusi-Bukan Komersial 4.0 Lesen Antarabangsa
Biomarker pada masa ini dikategorikan sebagai protein, penanda mutasi DNA, penanda epigenetik, kelainan kromosom, penanda RNA yang diperoleh secara langsung daripada tumor, atau serpihan tumor yang diperoleh secara tidak langsung daripada cecair badan.Penanda protein ialah biomarker yang paling banyak digunakan dalam pemeriksaan dan diagnosis kanser.Biomarker protein, sebagai penanda bio saringan, dihadkan oleh kecenderungan untuk terjejas oleh lesi jinak, yang membawa kepada overdiagnosis dan rawatan berlebihan, seperti yang telah dilaporkan untuk α-fetoprotein dan antigen khusus prostat (PSA)9,10.Penanda RNA termasuk corak ekspresi genetik dan penanda RNA bukan pengekodan lain. Gabungan penanda RNA ekspresi genetik boleh dikesan menggunakan sampel air kencing, sensitiviti yang jauh dari memuaskan (60%) untuk tumor primer, dan pengesanan yang boleh dipengaruhi oleh sifat mudah degradasi RNA dalam persekitaran normal11.Penanda genetik dan epigenetik kedua-duanya menghadapi masalah kelaziman dalam tumor dan had kepada jenis kanser.
Metilasi DNA telah menjadi calon yang kuat sebagai biomarker pengesanan awal sejak pertama kali dikaitkan dengan kanser oleh Feinberg pada 198312. Penyimpangan metilasi DNA diperhatikan dalam semua peringkat kanser, seawal peringkat prakanser.Hipermetilasi DNA yang menyimpang biasanya berlaku di pulau CpG dalam penganjur gen untuk mengatasi penindas tumor13,14.Kajian juga telah mencadangkan bahawa hipermetilasi DNA yang tidak normal terlibat dalam pengawalseliaan pengawalselia pembangunan15.Lembah metilasi DNA, yang biasanya dikaitkan dengan pengawal selia perkembangan dan kanser hipermetilasi, mungkin menukar mod ekspresi gen kepada mod yang bergantung kepada metilasi DNA yang lebih stabil dan mengurangkan sambungan kepada histon metilasi H3K27me3 dan protein polycomb yang berkaitan16,17.
Antara sebilangan besar penanda metilasi DNA yang diterbitkan, beberapa telah berjaya membuat debutnya di pasaran;Walau bagaimanapun, penanda metilasi DNA yang dikomersialkan dan panel diagnostik masih belum membuka sepenuhnya potensi pengesanan awal kanser atas pelbagai sebab18.Walaupun kebanyakannya menunjukkan prestasi yang boleh diterima menggunakan maklumat pangkalan data, biomarker ini biasanya menunjukkan prestasi yang kurang ideal dalam dunia nyata disebabkan oleh fakta bahawa sampel dunia sebenar selalunya lebih kompleks dan tidak mewakili seperti yang dipilih dalam pangkalan data.Pengesanan awal metilasi berbilang kanser berasaskan penjujukan generasi seterusnya telah terbukti mempunyai kepekaan hanya 16.8% dan 40.4% dalam kanser peringkat I dan II, masing-masing19.Ujian pengesanan awal memerlukan kestabilan yang lebih tinggi dan biomarker yang lebih tepat.
Penemuan penanda kanser sahaja (UCOM) sejagat menggunakan penjujukan kedudukan panduan (GPS)
Walaupun berdekad-dekad penyelidikan kanser, pencegahan dan rawatan yang memuaskan tidak dapat direalisasikan.Metodologi baru diperlukan untuk membolehkan penyelidik menilai kanser secara menyeluruh.Sepanjang 23 tahun yang lalu, 6 ciri kanser, seperti mengelak apoptosis, pencerobohan tisu & metastasis, dsb., telah diperluaskan kepada 14 dengan memasukkan ciri seperti pengaturcaraan semula epigenetik bukan mutasi dan mikrobiom polimorfik20,21.Apabila lebih banyak butiran yang melibatkan kanser diumumkan, lebih banyak perspektif diperkenalkan ke dalam penyelidikan kanser.Penyelidikan kanser secara beransur-ansur memasuki era baru dalam dua arah (kesamaan dan keperibadian).Dengan perkembangan onkologi ketepatan dalam beberapa tahun kebelakangan ini, tumpuan penyelidikan kanser bersandar kepada terapi sasaran individu dan heterogeniti kanser22.Oleh itu, biomarker kanser yang dikenal pasti baru-baru ini telah memberi tumpuan terutamanya pada jenis kanser tertentu, seperti PAX6 kanser serviks23 dan BMP3 untuk kanser kolorektal24.Prestasi biomarker khusus untuk jenis kanser ini berbeza-beza, tetapi masih tidak mungkin bagi individu yang terdedah untuk menjalani pemeriksaan untuk semua kanser secara serentak disebabkan oleh had pengambilan sampel biologi dan kos yang tinggi.Adalah sesuai jika kita dapat mengenal pasti biomarker tunggal yang teguh yang berkesan untuk semua jenis kanser pada peringkat awal.
Untuk mencapai matlamat yang ideal, calon biomarker yang lebih baik mesti dipilih daripada senarai jenis biomarker yang berpotensi.Penyimpangan metilasi DNA, di antara semua profil genetik dan epigenetik, diketahui berkaitan dengan kanser dan merupakan antara yang terawal, jika tidak terlebih dahulu, keabnormalan berkaitan kanser berlaku secara kronologi.Penyiasatan metilasi DNA bermula lebih awal, tetapi telah dihalang oleh kekurangan kaedah penyelidikan.Di antara 28 juta tapak CpG metilasi yang berpotensi dalam genom, nombor yang boleh diurus mesti dikesan dan diselaraskan dengan genom untuk lebih memahami tumorigenesis.Penjujukan keseluruhan genom bisulfit (WGBS), yang dianggap sebagai piawaian emas bagi penjujukan metilasi DNA, hanya boleh meliputi 50% Cs dalam sel kanser kerana sifat rawatan bisulfit yang memecahkan serpihan DNA dan merendahkan kerumitan genom semasa penjelmaan Cs-ke-Ts25.Kaedah lain, seperti cip 450k, hanya meliputi 1.6% metilasi genom.Berdasarkan 450k data, panel pengesanan metilasi DNA mempunyai sensitiviti 35.4% untuk 6 jenis kanser peringkat I26.Had jenis kanser, prestasi lemah dan bunyi bising yang dijana oleh kaedah pengesanan dalam proses analitik telah menjadi halangan terbesar bagi panel pengesanan kanser pan.
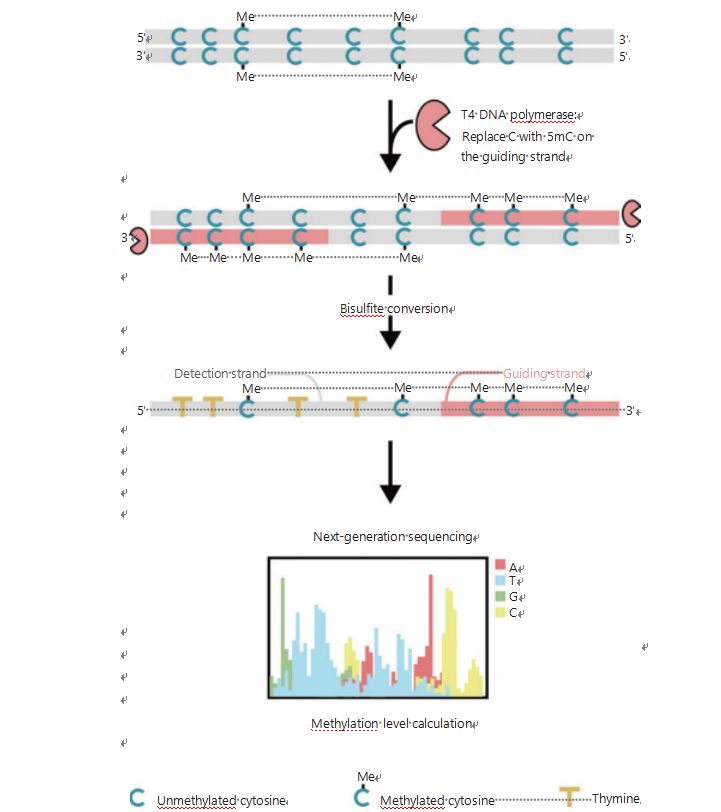
Untuk menyiasat lebih baik corak epigenetik sel semasa tumorigenesis dan metastasis, kami membangunkan GPS unik untuk pengesanan metilasi DNA seluruh genom, yang meliputi sehingga 96% tapak CpG dalam 0.4 bilion bacaan25.GPS ialah kaedah penjujukan dua hala menggunakan hujung 3′ serpihan DNA bagi metil-sitosin tidak boleh tukar selepas rawatan bisulfit yang membimbing penjajaran pengiraan metilasi DNA hujung 5′ melalui penjujukan hujung berpasangan (Rajah 1)25.Untai pemandu metil-sitosin, bertindak sebagai helai templat, membantu dalam penjajaran rantau GC tinggi yang memulihkan data penjujukan yang paling terbengkalai dalam WGBS tradisional.Ciri liputan tinggi GPS menyediakan sejumlah besar maklumat metilasi DNA, yang membolehkan kita memeriksa profil metilasi kanser dengan resolusi yang jauh lebih tinggi di kawasan yang kurang disiasat sebelum ini.
GPS membekalkan kita alat yang berkuasa untuk menyiasat kehomogenan kanser, yang boleh memudahkan penyelidikan kanser dan berpotensi mencari penjelasan universal untuk tumor-origenesis dan metastasis.Semasa menganalisis data GPS saluran sel kanser, fenomena unik sering ditemui.Terdapat beberapa kawasan yang kelihatan tidak normal hipermetilasi dalam pelbagai jenis sampel kanser.Penemuan yang tidak dijangka ini kemudiannya disahkan untuk berfungsi sebagai UCOM.Lebih daripada 7,000 sampel daripada 17 jenis kanser dalam pangkalan data The Cancer Genome Atlas (TCGA) telah dianalisis, antaranya kami mengenal pasti UCOM pertama, HIST1H4F, gen berkaitan histon yang hipermetilasi dalam semua jenis kanser27.Satu siri UCOM kemudiannya ditemui dan disahkan dalam pangkalan data TCGA, pangkalan data Gene Expression Omnibus (GEO) dan sampel klinikal dunia sebenar.Sehingga kini, HIST1H4F, PCDHGB7 dan SIX6 telah ditemui dan disahkan sebagai UCOM.Penemuan UCOM yang tidak dijangka menawarkan jawapan yang kuat untuk keperluan pengesanan awal kanser.UCOM menyediakan penyelesaian untuk pengesanan penanda tunggal bagi pelbagai jenis kanser.
Ciri-ciri UCOM
Selepas pengesahan, UCOM telah ditunjukkan mempamerkan empat ciri utama yang membolehkan UCOM melepasi keberkesanan biomarker semasa (Rajah 2).
Unik kepada keganasan
UCOM adalah unik kepada lesi kanser atau pra-kanser dan tidak terjejas oleh perubahan fisiologi biasa.Beberapa penanda berkaitan kanser semasa yang telah digunakan secara meluas dalam pengesanan awal dan/atau saringan telah membawa kepada overdiagnosis.Tahap PSA yang tinggi, alat pemeriksaan yang diiktiraf secara klinikal, juga dikesan dalam keadaan jinak, seperti hiperplasia prostat dan prostatitis10.Diagnosis berlebihan dan rawatan berlebihan yang terhasil membawa kepada penurunan kualiti hidup akibat komplikasi usus, kencing dan seksual28.Biomarker berasaskan protein dan digunakan secara meluas dalam persekitaran klinikal, seperti CA-125, tidak menghasilkan faedah yang ketara semasa mengalami overdiagnosis dan rawatan berlebihan29.Kekhususan tinggi UCOM untuk keganasan mengelakkan kekurangan ini.UCOM, PCDHGB7, dengan cekap membezakan lesi intraepithelial skuamosa gred tinggi (HSIL) dan kanser serviks daripada sampel biasa dan lesi intraepithelial skuamosa gred rendah (LSIL), manakala kebanyakan penanda bio lain hanya boleh membezakan kanser serviks daripada sampel biasa30.Walaupun PCDHGB7 tidak mengesan perbezaan ketara antara endometrium normal dan hiperplasia endometrium, perbezaan ketara dikesan antara endometrium normal dan hiperplasia atipikal, dan perbezaan yang lebih besar dikesan antara endometrium normal dan kanser endometrium (EC) berdasarkan PCDHGB731.UCOM adalah unik kepada lesi malignan dalam pangkalan data dan sampel klinikal.Dari perspektif pesakit, UCOM unik mengurangkan ambang untuk memahami petunjuk kompleks pelbagai biomarker tidak stabil berprestasi buruk dan kebimbangan yang sepadan semasa proses penilaian.Dari perspektif klinik, UCOM unik membezakan keganasan daripada lesi jinak, yang membantu dalam triage pesakit dan mengurangkan prosedur perubatan yang tidak perlu dan rawatan berlebihan.Oleh itu, UCOM unik mengurangkan lebihan sistem perubatan, melegakan tekanan sistem, dan menyediakan lebih banyak sumber perubatan kepada mereka yang memerlukan.
Rajah 1 Skema aliran kerja GPS untuk pengesanan metilasi DNA25.Garis kelabu: masukan urutan DNA;garis merah: DNA dirawat dengan polimerase DNA T4, menggantikan sitosin dengan 5'-metilcytosine pada hujung 3' input;biru C dengan Saya: sitosin termetilasi;biru C: sitosin tidak termetilasi;kuning T: timin25.
Semua atau tiada
UCOM hanya terdapat dalam sel kanser dan dikesan secara stabil dalam hampir semua sel kanser.HIST1H4F telah disahkan untuk hipermetilasi dalam hampir semua jenis tumor tetapi tidak dalam sampel biasa27.Begitu juga, PCDHGB7 dan ENAM juga telah ditunjukkan sebagai hipermetilasi dalam semua sampel tumor tetapi tidak dalam sampel normal30-32.Ciri unik ini meningkatkan prestasi UCOM dengan ketara berkaitan dengan had pengesanan dan kepekaan.Sekurang-kurangnya 2% sel kanser boleh dibezakan dalam sampel, menjadikan UCOM sebagai biomarker yang jauh lebih sensitif daripada kebanyakan biomarker sedia ada30. Sebagai biomarker yang digunakan untuk pengesanan kanser kolorektal, mutasi KRAS hanya wujud dalam kira-kira 36% kes kanser kolorektal, mencadangkan potensi diagnostik yang lemah33.Kelaziman rendah mutasi KRAS dalam kanser kolorektal mengehadkan KRAS dalam kombinasi dengan biomarker lain.Malah, gabungan biomarker mungkin kelihatan menjanjikan pada mulanya, tetapi tidak selalu menjana hasil yang memuaskan sambil menunjukkan bunyi yang lebih besar dalam analisis pengesanan dan biasanya melibatkan prosedur eksperimen yang lebih rumit.Sebaliknya, PCDHGB7 dan UCOM lain wujud dalam semua kanser.UCOM mengesan komponen kanser dalam pelbagai jenis sampel kanser dengan ketepatan yang tinggi sambil membasmi proses analisis pembatalan hingar yang kompleks.Tidak sukar untuk mengesan kanser dalam sampel yang banyak, tetapi sangat mencabar untuk mengesan kanser dalam sampel yang kecil.UCOM mampu mengesan sejumlah kecil kanser.
Rajah 2 Ciri-ciri UCOM.
Pengesanan kanser sebelum perubahan patologi
UCOM boleh dikesan pada peringkat pra-kanser sebelum perubahan patologi.Sebagai biomarker epigenetik, keabnormalan UCOM berlaku pada peringkat lebih awal daripada keabnormalan fenotip dan dapat dikesan sepanjang tumorigenesis, perkembangan, dan metastasis34,35.Sensitiviti UCOM dari semasa ke semasa meningkatkan prestasi UCOM dalam mengesan kanser peringkat awal dan lesi pra-kanser.Pengesanan kanser awal berdasarkan biopsi dan sitologi boleh menjadi sukar bagi ahli patologi yang paling berpengalaman sekalipun.Satu biopsi yang diperoleh melalui kolposkopi telah dilaporkan sebagai positif dalam 60.6% sampel HSIL+.Biopsi tambahan diperlukan untuk pelbagai lesi untuk meningkatkan sensitiviti36.Sebaliknya, UCOM, PCDHGB7, mempunyai kepekaan sebanyak 82% untuk sampel HSIL+, melebihi sensitiviti biopsi dan kebanyakan biomarker30.Penanda metilasi, FAM19A4, mempunyai sensitiviti 69% untuk CIN2+, yang serupa dengan sitologi, tetapi tidak dapat membezakan CIN1 daripada sampel biasa37.UCOM telah ditunjukkan sebagai biomarker pengesanan awal yang lebih sensitif.Berbanding dengan pakar patologi berasaskan pengalaman, UCOM mempunyai sensitiviti pengesanan yang lebih baik untuk kanser peringkat awal, yang seterusnya menyumbang kepada prognosis dan kelangsungan hidup kanser yang lebih baik30.Selain itu, UCOM menawarkan platform pengesanan yang boleh diakses kepada kawasan yang tidak mempunyai pakar patologi yang berpengalaman dan meningkatkan kecekapan pengesanan.Dengan prosedur pensampelan dan pengesanan yang seragam, pengesanan UCOM menghasilkan keputusan yang stabil dan mudah ditafsir yang lebih sesuai dengan protokol saringan yang memerlukan lebih sedikit kakitangan profesional dan sumber perubatan.
Mudah dikesan
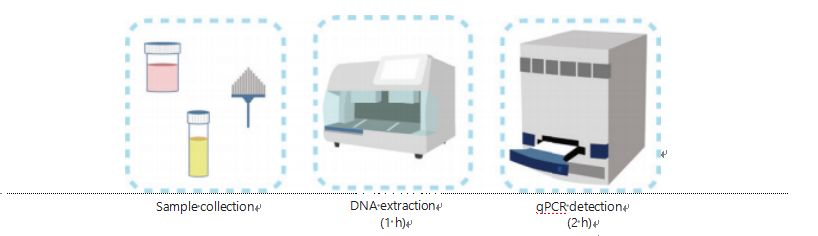
Kaedah semasa untuk pengesanan metilasi DNA adalah rumit dan memakan masa.Kebanyakan kaedah memerlukan transformasi bisulfit, yang menyebabkan kehilangan kualiti sampel dan mungkin menghasilkan keputusan yang tidak stabil dan tidak tepat.Kebolehulangan yang lemah yang disebabkan oleh rawatan bisulfit berpotensi membawa kepada kekeliruan bagi doktor dan pesakit dan seterusnya mengganggu strategi susulan dan/atau rawatan.Oleh itu, kami seterusnya mengubah suai kaedah pengesanan UCOM untuk mengelakkan rawatan bisulfit yang bermasalah bagi sampel, menampung keperluan aplikasi klinikal, dan meningkatkan kebolehcapaian.Kami membangunkan kaedah baru menggunakan enzim sekatan sensitif metilasi yang digabungkan dengan PCR kuantitatif pendarfluor masa nyata (Me-qPCR) untuk mengukur status metilasi UCOM dalam masa 3 jam menggunakan prosedur pengendalian yang mudah (Rajah 3).Me-qPCR boleh menampung pelbagai jenis sampel, seperti pengumpulan klinikal cecair badan dan sampel air kencing yang dikumpul sendiri.Sampel klinikal yang dikumpul boleh diproses, disimpan dan dengan mudah meneruskan pengesanan menggunakan pengekstrakan DNA yang standard dan automatik.DNA yang diekstrak kemudiannya boleh digunakan terus pada platform Me-qPCR untuk tindak balas satu periuk dan hasil kuantifikasi output.Selepas analisis keputusan mudah menggunakan model diagnostik yang dipasang dan disahkan kepada jenis kanser tertentu, penentuan akhir keputusan pengesanan UCOM ditafsir dan dibentangkan sebagai nilai separa kuantitatif.Platform Me-qPCR mengatasi prestasi bisulfit-pyrosequencing tradisional dalam pengesanan UCOM sambil menjimatkan 3 jam penukaran bisulfit, menurut protokol kit EZ DNA Methylation-Gold.Platform pengesanan metilasi yang inovatif menjadikan pengesanan UCOM lebih stabil, lebih tepat dan lebih mudah diakses30.
Rajah 3 Proses pengesanan UCOM.Jenis sampel termasuk BALF sampel profesional, berus Pap dan/atau air kencing yang dikumpul sendiri.Proses pengekstrakan DNA boleh ditempatkan pada pengekstrak automatik, produk yang boleh dikesan secara langsung oleh qPCR.
Penggunaan UCOM
Kanser paru-paru
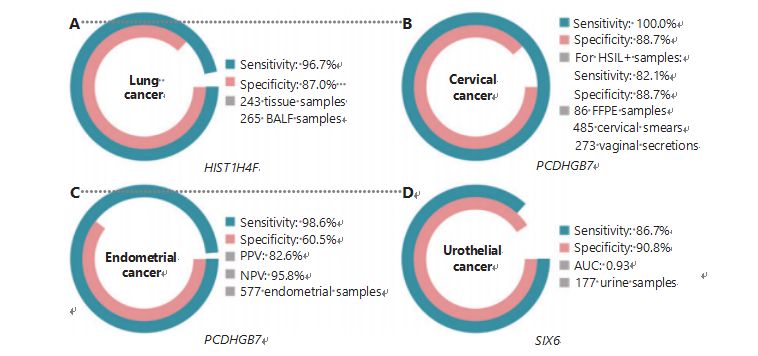
Kanser paru-paru adalah kanser kedua paling kerap didiagnosis dan paling mematikan di seluruh dunia, menyumbang 11.4% daripada kes baharu dan 18.0% daripada kematian baharu1.Di antara semua diagnosis, 85% adalah kanser paru-paru bukan sel kecil (NSCLC) dan 15% adalah kanser paru-paru sel kecil (SCLC), yang mempunyai tahap keganasan yang lebih tinggi38.Pengimbasan tomografi berkomputer dos rendah (LDCT) ialah kaedah pemeriksaan yang disyorkan pada masa ini untuk kanser paru-paru dan telah ditunjukkan dapat meningkatkan pengesanan awal dan mengurangkan kematian6;bagaimanapun, disebabkan kekhususan yang rendah dan kebolehcapaian yang lemah, LDCT masih belum berfungsi sebagai kaedah saringan yang memuaskan, seperti juga penanda kanser biasa yang lain, seperti CEA39.Kos dan potensi untuk terlepas diagnosis dan salah diagnosis strategi saringan LDCT menghalang kemajuan promosi saringan kanser paru-paru40.HIST1H4F, UCOM, mempunyai potensi besar sebagai biomarker pengesanan awal dalam sampel cecair bronchoalveolar (BALF)27.HIST1H4F dihipermetilasi dalam adenokarsinoma paru-paru dan karsinoma sel skuamosa paru-paru, dengan kekhususan pengesanan 96.7% dan kepekaan 87.0% (Rajah 4A), dan prestasi yang luar biasa untuk kanser peringkat I27.HIST1H4F mempunyai kekhususan 96.5% dan sensitiviti 85.4% untuk NSCLC, dan 96.5% dan 95.7%, masing-masing untuk SCLC27.Selain itu, sampel lapan jenis kanser lain, termasuk kanser pankreas dan kolorektal, telah mengesahkan bahawa HIST1H4F adalah hipermetilasi dalam kesemua lapan jenis27.
Kanser serviks
Kanser serviks ialah kanser keempat paling kerap didiagnosis dan punca keempat kematian kanser pada wanita pada tahun 2020, menyumbang 3.1% daripada kes baharu dan 3.4% daripada kematian berkaitan kanser di seluruh dunia1.Untuk menghapuskan kanser serviks menjelang 2030, seperti yang dicadangkan oleh WHO, pengesanan awal kanser serviks adalah satu keperluan.Jika dikesan pada peringkat awal, kadar survival 5 tahun mencapai 92% dengan kanser serviks invasif41.Garis panduan American Cancer Society (ACS) mencadangkan ujian sitologi serviks, ujian HPV utama, atau kotes untuk saringan42.Sitologi serviks adalah invasif dan hanya boleh mengesan 63.5% daripada kes CIN2+37.
PCDHGB7, sebaliknya, telah menunjukkan prestasi yang lebih baik menggunakan Pap smear dan rembesan faraj, dan boleh membezakan HSIL daripada LSIL dengan cekap pada peringkat ultra-awal.PCDHGB7 sahaja mempunyai sensitiviti 100.0% dan kekhususan 88.7% untuk kanser serviks (Rajah 4B), dan sensitiviti 82.1% dan kekhususan 88.7% untuk sampel HSIL+30.PCDHGB7 juga mempunyai sensitiviti 90.9% dan kekhususan 90.4% dalam sampel rembesan faraj untuk kanser serviks, yang lebih mudah untuk dikumpulkan30.Apabila digabungkan dengan ujian HPV (jam) berisiko tinggi atau Ujian Sitologi Thinprep (TCT), PCDHGB7 mempunyai kepekaan yang meningkat sebanyak 95.7% dan kekhususan sebanyak 96.2%, dengan ketara mengatasi ujian hrHPV (20.3%), TCT (51.2%). ), dan kedua-duanya digabungkan (57.8%) untuk kanser serviks30.PCDHGB7 juga telah terbukti hipermetilasi dalam 17 jenis kanser daripada pangkalan data TCGA, menunjukkan kesesuaiannya dalam keluarga UCOM30.
Rajah 4 UCOM telah disahkan dalam empat jenis kanser dalam kajian klinikal berskala besar.A. Prestasi HIST1H4F, UCOM, dalam pengesanan kanser paru-paru sebanyak 508 sampel.B. Prestasi PCDHGB7, UCOM, dalam pengesanan kanser serviks sebanyak 844 sampel.C. Prestasi PCDHGB7, UCOM, dalam pengesanan kanser endometrium bagi 577 sampel berus Pap endometrium dan Tao.D. Prestasi SIX6, UCOM, dalam pengesanan kanser urothelial sebanyak 177 sampel.
EC
EC ialah salah satu kanser sistem pembiakan wanita yang paling biasa di seluruh dunia, dengan anggaran 4.2 juta kes baharu dan 1% kematian berkaitan kanser setiap tahun1.Dengan diagnosis yang berjaya pada peringkat awal, EC boleh dirawat dan mempunyai kadar kelangsungan hidup 5 tahun sebanyak 95% untuk kanser peringkat I.Pesakit yang bergejala, seperti pendarahan rahim yang tidak normal, menerima penilaian klinikal berkala dan menjalani prosedur biopsi yang invasif dan menyakitkan, walaupun hanya 5%–10% akhirnya membangunkan EC43.Ultrabunyi transvaginal, sebagai kaedah pengesanan biasa, adalah sangat tidak boleh dipercayai kerana ketidakupayaannya untuk membezakan perubahan endometrial benigna daripada malignan dan kadar positif palsu yang tinggi44.
Perbandingan selari serum CA-125, biomarker EC yang dilaksanakan secara meluas, dan PCDHGB7 telah dijalankan.Serum CA-125 mempunyai sensitiviti 24.8%, yang menunjukkan bahawa CA-125 adalah penanda yang tidak mencukupi untuk EC walaupun kekhususan 92.3%31.Pengesanan PCDHGB7 menggunakan sampel berus Pap menghasilkan sensitiviti 80.65% dan kekhususan 82.81% untuk peringkat ECatall, manakala berus Tao mempunyai sensitiviti 61.29% dan kekhususan 95.31%31.Model diagnostik PCDHGB7, berdasarkan Me-qPCR, menghasilkan sensitiviti 98.61%, kekhususan 60.5%, dan ketepatan keseluruhan 85.5%, menggunakan sampel berus Pap dan Tao (Rajah 4C)31.
Kanser urothelial
Kanser urothelial, yang terdiri daripada kanser pundi kencing, pelvis buah pinggang, dan ureter, adalah kanser ketujuh yang paling kerap didiagnosis pada tahun 2020 di seluruh dunia, menyebabkan 5.2% kes baharu dan 3.9% kematian1.Kanser urothelial, lebih daripada 50% daripadanya adalah kanser pundi kencing, merupakan kanser keempat yang paling kerap didiagnosis di Amerika Syarikat pada tahun 2022, menyumbang 11.6% daripada kes yang baru didiagnosis3.Kira-kira 75% daripada kanser pundi kencing dikelaskan sebagai kanser pundi kencing invasif bukan otot yang terhad kepada mukosa atau submukosa45.Biopsi sistoskopi ialah piawaian emas untuk mendiagnosis kanser urothelial yang dilaksanakan oleh pendarfluor in situ hibridisasi (FISH) dan ujian sitologi.IKAN dan sitologi mempunyai prestasi diagnostik yang lemah, dan sistoskopi mengganggu dan mempunyai risiko asas kehilangan mikrolesi, salah tafsir lesi dan berpotensi menyebabkan penyebaran atau kambuh semula kanser46.UCOM yang disahkan sebelum ini, PCDHGB7, juga ditunjukkan sebagai hipermetilasi dalam kanser urothelial, dengan kawasan di bawah lengkung 0.86, menunjukkan potensi keupayaan diagnostik30.Untuk mengesahkan lebih banyak UCOM dan menampung lebih banyak jenis sampel dengan lebih baik, SIX6, UCOM novel, telah diperiksa dan menunjukkan potensi diagnostik yang sangat baik dalam pengesanan awal kanser urothelial menggunakan sampel air kencing pada platform Me-qPCR.Pengesanan ENAM menggunakan sampel air kencing menunjukkan sensitiviti daya saing sebanyak 86.7% dan kekhususan 90.8% (Rajah 4D), sementara tidak invasif dan mudah diperoleh32.Potensi ENAM dalam pemantauan metastasis dan penilaian keberkesanan rawatan sedang disiasat.
Masa depan dan cabaran
UCOM mempunyai prestasi yang kukuh dalam potensi diagnostik pelbagai jenis kanser, tetapi masih banyak kerja yang perlu dilakukan.Kami telah mengembangkan senarai UCOM dan telah secara aktif mengesahkan UCOM dalam lebih banyak jenis kanser, termasuk yang secara tradisinya sukar dikesan.Keputusan pengesahan daripada pangkalan data TCGA telah menguatkan lagi aplikasi UCOM dalam lebih banyak jenis kanser dan lebih banyak situasi.Dalam penyiasatan awal, UCOM telah terbukti mempunyai potensi diagnostik yang teguh untuk kolangiokarsinoma dan adenokarsinoma pankreas, yang hampir mustahil untuk didiagnosis pada peringkat awal dengan kaedah pemeriksaan semasa32,47.Keupayaan untuk mengesan kanser yang jarang berlaku dengan UCOM boleh digunakan dengan DNA tumor yang beredar (ctDNA) oleh platform biopsi cecair yang lebih baik48.Satu kajian yang melibatkan panel pengesanan kanser pan-kanser berasaskan DNA plasma menghasilkan sensitiviti sebanyak 57.9%49.Walaupun kekhususan yang tinggi, prestasi keseluruhan mendedahkan bahawa masih terdapat ruang untuk penambahbaikan.
Ciri unik UCOM juga telah menyokong penyiasatan potensi UCOM dalam penilaian keberkesanan rawatan dan pemantauan berulang.Menurut Kriteria Penilaian Respons dalam Tumor Pepejal (RECIST), pengimejan perubatan ialah metodologi yang disyorkan untuk pemantauan berulang dan penilaian keberkesanan rawatan, manakala penanda tumor digunakan sahaja untuk penilaian50.Pada hakikatnya, bagaimanapun, pendekatan pengimejan sangat dipengaruhi oleh kekerapan dan masa, dan oleh itu mendedahkan pesakit kepada risiko dan kos yang lebih tinggi51,52.ENAM telah disahkan untuk berfungsi sebagai peramal untuk metastasis kanser payudara32.Pemantauan ctDNA berasaskan biopsi cecair membolehkan pengawasan masa nyata ke atas sisa penyakit yang minimum beberapa bulan sebelum pengesanan radiologi, secara idealnya menangguhkan dan mencegah perkembangan kanser berkaitan kambuh semula53.Keputusan awal menunjukkan bahawa UCOM mencerminkan tahap hipermetilasi kanser dalam masa nyata sejurus selepas pembedahan dan rawatan32.Kepekaan tinggi yang dipamerkan oleh UCOM dan kebolehgunaan dalam pelbagai jenis sampel tidak mengganggu membolehkan UCOM berfungsi sebagai biomarker pemantauan berulang yang tepat sambil mengekalkan pematuhan pesakit yang tinggi.
Pada masa yang sama, akses awam kepada ujian adalah satu lagi isu utama yang memerlukan usaha tambahan.Walaupun kerjasama pengesanan UCOM telah diterima pakai di lebih banyak hospital dengan harapan dapat memanfaatkan lebih ramai pesakit, pengesanan dan pemeriksaan pro bono telah dilakukan secara aktif di luar bandar China.UCOM memerlukan kebolehcapaian yang lebih baik untuk melayakkan diri sebagai alat penyaringan yang boleh dilaksanakan, terutamanya untuk kawasan yang kurang membangun.
Walaupun hasil aplikasi UCOM dalam pengesanan awal adalah menjanjikan, banyak perkara yang tidak diketahui tentang UCOM wujud.Dengan penerokaan aktif, penyelidikan tambahan adalah wajar tentang sebab UCOM hadir secara universal dalam kanser.Mekanisme peraturan epigenetik yang mendasari UCOM layak untuk disiasat lanjut, yang boleh membenarkan arah baru untuk terapeutik kanser.Kembali kepada interaksi antara kehomogenan tumor dan heterogeniti, kami tertarik dengan sebab UCOM boleh menjadi pengecualian kepada majoriti biomarker kanser yang berkait rapat dengan jenis kanser tertentu.Peranan penyimpangan metilasi DNA yang dikenal pasti UCOM dalam tumorigenesis, perkembangan tumor, dan metastasis belum ditentukan dalam proses kehilangan dan mendapatkan semula identiti sel dan memerlukan pemeriksaan menyeluruh.Satu lagi minat utama terletak pada skop penggabungan sifat homogeniti UCOM dengan penanda unik tisu dengan harapan dapat menghampiri pengesanan tepat bagi kesan kanser dan pengenalpastian asal-usul tisu tumor secara terbalik.UCOM boleh menjadi alat yang ideal untuk mencegah kanser, mengesan kanser, dan berpotensi mempertahankan dan menghapuskan kanser.
Berikan sokongan
Kerja ini disokong oleh Program R&D Utama Negara China (No. Geran 2022BEG01003), Yayasan Sains Semula Jadi Kebangsaan China (No. Geran 32270645 dan 32000505), Geran daripada Suruhanjaya Kesihatan Wilayah Heilongjiang (No. Geran 2020-111) , dan Geran daripada Institut Sains dan Teknologi Heze (No. Geran 2021KJPT07).
Penyata konflik kepentingan
Wei Li ialah Pengarah R&D untuk Shanghai Epiprobe Biotechnology Co., Ltd. Wenqiang Yu berkhidmat dalam Lembaga Penasihat Saintifik Epiprobe.W. Yu dan Epiprobe telah meluluskan paten yang belum selesai berkaitan dengan kerja ini.Semua pengarang lain mengisytiharkan tiada kepentingan bersaing.
Sumbangan pengarang
Mengandung dan mereka projek: Chengchen Qian dan Wenqiang Yu.
Menulis kertas: Chengchen Qian.
Membuat ilustrasi: Chengchen Qian.
Menyemak dan menyunting manuskrip: Xiaolong Zou, Wei Li, Yinshan Li dan Wenqiang Yu.
Rujukan
1. Sung H, Ferlay J, Siegel RL, LaversanneM, Soerjomataram I, Jemal A, et al.Statistik Kanser Global 2020: Anggaran GLOBOCAN bagi
insiden dan kematian di seluruh dunia untuk 36 kanser di 185 negara.CA Kanser J Clin.2021;71: 209-49.
2. Xia C, Dong X, Li H, Cao M, Sun D, He S, et al.Statistik kanser di China dan Amerika Syarikat, 2022: profil, arah aliran dan penentu.Chin MedJ (Engl).2022;135: 584-90.
3. Siegel RL, Miller KD, WagleNS, JemalA.Statistik kanser, 2023. CA Cancer J Clin.2023;73: 17-48.
4. Crosby D, BhatiaS, Brindle KM, Coussens LM, Dive C, Emberton M, et al.Pengesanan awal kanser.Sains.2022;375: eaay9040.
5. Ladabaum U, Dominitz JA, KahiC, Schoen RE.Strategi untuk
pemeriksaan kanser kolorektal.Gastroenterologi.2020;158: 418-32.
6. Tanoue LT, Tanner NT, Gould MK, Silvestri GA.Pemeriksaan kanser paru-paru.Am J Respir Crit Care Med.2015;191: 19-33.
7. Bouvard V, WentzensenN, Mackie A, Berkhof J, BrothertonJ, Giorgi-Rossi P, et al.Perspektif IARC mengenai pemeriksaan kanser serviks.N EnglJ Med.2021;385: 1908-18.
8. Xue P, Ng MTA, QiaoY.Cabaran kolposkopi untuk pemeriksaan kanser serviks dalam LMIC dan penyelesaian oleh kecerdasan buatan.BMC Med.2020;18: 169.
9. Johnson P, Zhou Q, Dao DY, Lo YMD.Biomarker beredar dalam diagnosis dan pengurusan karsinoma hepatoselular.Nat Rev Gastroenterol Hepatol.2022;19: 670-81.
10. Van PoppelH, Albreht T, Basu P, HogenhoutR, CollenS, Roobol M. Pengesanan awal kanser prostat berasaskan PSA serum di Eropah dan global: masa lalu, sekarang dan masa depan.Nat Rev Urol.2022;19:
562-72.
11. HolyoakeA, O'Sullivan P, Pollock R, Best T, Watanabe J, KajitaY,
et al.Pembangunan ujian air kencing RNA multipleks untuk pengesanan dan stratifikasi karsinoma sel peralihan pundi kencing.Clin Cancer Res.2008;14: 742-9.
12. Feinberg AP, Vogelstein B. Hypomethylation membezakan gen sesetengah kanser manusia daripada rakan biasa mereka.alam semula jadi.1983;301: 89-92.
13. Ng JM, Yu J. Penggalak hipermetilasi gen penindas tumor sebagai biomarker berpotensi dalam kanser kolorektal.IntJ Mol Sci.2015;16: 2472-96.
14. Esteller M. Epigenomik kanser: Metilom DNA dan peta pengubahsuaian histon.Nat Rev Genet.2007;8: 286-98.
15. Nishiyama A, Nakanishi M. Menavigasi landskap metilasi DNA kanser.Trend Genet.2021;37: 1012-27.
16. Xie W, Schultz MD, ListerR, Hou Z, Rajagopal N, Ray P, et al.Analisis epigenomik pembezaan multilineage sel stem embrio manusia.sel.2013;153: 1134-48.
17. Li Y, Zheng H, Wang Q, Zhou C, WeiL, Liu X, et al.Analisis seluruh genom mendedahkan peranan Polycomb dalam mempromosikan hipometilasi lembah metilasi DNA.Biol Genom.2018;19:18.
18. Koch A, JoostenSC, Feng Z, de Ruijter TC, DrahtMX, MelotteV,
et al.Analisis metilasi DNA dalam kanser: lokasi dikaji semula.Nat Rev Clin Oncol.2018;15: 459-66.
19. KleinEA, Richards D, Cohn A, TummalaM, Lapham R, Cosgrove D, et al.Pengesahan klinikal ujian pengesanan awal pelbagai kanser berasaskan metilasi yang disasarkan menggunakan set pengesahan bebas.Ann Oncol.2021;32: 1167-77.
20. Hanahan D, Weinberg RA.Ciri-ciri kanser.sel.2000;100: 57-70.
21. Hanahan D. Ciri-ciri kanser: dimensi baharu.Discov Kanser.2022;12: 31-46.
22. Schwartzberg L, Kim ES, Liu D, Schrag D. Onkologi ketepatan: siapa, bagaimana, apa, bila, dan bila tidak?Buku Am Soc Clin Oncol Educ.2017: 160-9.
23. Liu H, Meng X, Wang J. Metilasi kuantitatif masa nyata
pengesanan gen PAX1 dalam pemeriksaan kanser serviks.Kanser Gynecol IntJ.2020;30: 1488-92.
24. Imperiale TF, RansohoffDF, Itzkowitz SH, Levin TR, Lavin P, Lidgard GP, et al.Ujian DNA multitargetstool untuk saringan kanser kolorektal.N EnglJ Med.2014;370: 1287-97.
25. Li J, Li Y, Li W, Luo H, Xi Y, Dong S, et al.Kedudukan panduan
penjujukan mengenal pasti corak metilasi DNA menyimpang yang mengubah identiti sel dan rangkaian pengawasan tumor-imun.Genom
Res.2019;29: 270-80.
26. Gao Q, LinYP, Li BS, Wang GQ, Dong LQ, Shen BY, et al.Pengesanan berbilang kanser yang tidak mengganggu dengan mengedarkan penjujukan metilasi DNA bebas sel (THUNDER): pembangunan dan kajian pengesahan bebas.Ann Oncol.2023;34: 486-95.
27. Dong S, Li W, Wang L, Hu J, Song Y, Zhang B, et al.Gen berkaitan histon adalah hipermetilasi dalam kanser paru-paru dan hipermetilasi
HIST1H4F boleh berfungsi sebagai biomarker pan-kanser.Kanser Re.2019;79: 6101-12.
28. HeijnsdijkEA, Wever EM, AuvinenA, Hugosson J, Ciatto S, Nelen V, et al.Kesan kualiti hidup pemeriksaan antigen khusus prostat.N EnglJ Med.2012;367: 595-605.
29. LuzakA, Schnell-Inderst P, Bühn S, Mayer-Zitarosa A, Siebert U. Keberkesanan klinikal ujian biomarker pemeriksaan kanser yang ditawarkan sebagai perkhidmatan kesihatan bayar sendiri: kajian sistematik.Kesihatan Awam Eur J.2016;26: 498-505.
30. Dong S, Lu Q,Xu P, Chen L, Duan X, Mao Z, et al.
Hypermethylated PCDHGB7 sebagai penanda kanser sejagat sahaja dan aplikasinya dalam saringan awal kanser serviks.Clin Transl Med.2021;11: e457.
31. Yuan J, Mao Z, Lu Q,Xu P, Wang C, Xu X, et al.PCDHGB7 hipermetilasi sebagai biomarker untuk pengesanan awal kanser endometrium dalam sampel berus endometrium dan pengikisan serviks.Depan Mol Biosci.2022;8: 774215.
32. Dong S, Yang Z,Xu P, Zheng W, Zhang B, Fu F, et al.bersama
pengubahsuaian epigenetik eksklusif pada SIX6 dengan hipermetilasi untuk peringkat prakanser dan pengesanan kemunculan metastasis.Sasaran Transduksi Isyarat Di sana.2022;7: 208.
33. Huang L, Guo Z,Wang F, Fu L. KRAS mutasi: daripada tidak boleh dirawat kepada dadah dalam kanser.Sasaran Transduksi Isyarat Di sana.2021;6: 386.
34. Belinsky SA, Nikula KJ, PalmisanoWA, MichelsR, SaccomannoG, GabrielsonE, et al.Metilasi menyimpang p16(INK4a) adalah kejadian awal dalam kanser paru-paru dan biomarker yang berpotensi untuk diagnosis awal.Proc Natl Acad Sci U SA.1998;95: 11891-6.
35. Robertson KD.Metilasi DNA dan penyakit manusia.Nat Rev Genet.2005;6: 597-610.
36. WentzensenN, Walker JL, Gold MA, Smith KM, ZunaRE,
Mathews C, et al.Pelbagai biopsi dan pengesanan prekursor kanser serviks pada kolposkopi.J Clin Oncol.2015;33: 83-9.
37. De Strooper LM, Meijer CJ, Berkhof J, Hesselink AT, Snijders
PJ, Steenbergen RD, et al.Analisis metilasi FAM19A4
gen dalam goresan serviks sangat cekap dalam mengesan serviks
karsinoma dan lesi CIN2/3 lanjutan.Kanser Prev Res (Phila).2014;7: 1251-7.
38. Thai AA, Solomon BJ, Sequist LV, Gainor JF, Heist RS.Kanser paru-paru.Lancet.2021;398: 535-54.
39. Grunnet M, Sorensen JB.Antigen karsinoembrionik (CEA) sebagai penanda tumor dalam kanser paru-paru.Kanser paru-paru.2012;76: 138-43.
40. Wood DE, KazerooniEA, Baum SL, EapenGA, EttingerDS, Hou L, et al.Pemeriksaan Kanser Paru-paru, Versi 3.2018, Garis Panduan Amalan Klinikal NCCN dalam Onkologi.J Natl Compr Canc Netw.2018;16: 412-41.
41. Persatuan Kanser Amerika.Fakta & angka kanser.Atlanta, GA, Amerika Syarikat: American Cancer Society;2023 [dikemas kini 2023 1 Mac;dipetik 2023 Ogos 22].
42. FonthamETH, Wolf AMD, Church TR, EtzioniR, Flowers CR,
Herzig A, et al.Pemeriksaan kanser serviks untuk individu berisiko purata: kemas kini garis panduan 2020 daripada American Cancer Society.CA Kanser J Clin.2020;70: 321-46.
43. Clarke MA, Long BJ, Del Mar MorilloA, Arbyn M, Bakkum-Gamez JN, Wentzensen N. Persatuan risiko kanser endometrium dengan pendarahan selepas menopaus pada wanita: kajian sistematik dan meta-analisis.JAMA Intern Med.2018;178: 1210-22.
44. Jacobs I, Gentry-MaharajA, Burnell M, ManchandaR, Singh N,
Sharma A, et al.Sensitiviti pemeriksaan ultrasound transvaginal
untuk kanser endometrium pada wanita menopaus: kajian kawalan kes dalam kohort UKCTOCS.Lancet Oncol.2011;12: 38-48.
45. BabjukM, Burger M, CompératEM, Gontero P, MostafidAH,
PalouJ, et al.Garis Panduan Persatuan Urologi Eropah mengenai Kanser Pundi kencing bukan invasif otot (TaT1 dan Karsinoma In Situ) -
Kemas Kini 2019.Eur Urol.2019;76: 639-57.
46. Aragon-Ching JB.Cabaran dan kemajuan dalam diagnosis, biologi, dan rawatan karsinoma saluran atas urothelial dan pundi kencing.Urol Oncol.2017;35: 462-4.
47. Rizvi S, KhanSA, Hallemeier CL, Kelley RK, Gores GJ.
Cholangiocarcinoma – konsep yang berkembang dan strategi terapeutik.Nat Rev Clin Oncol.2018;15: 95-111.
48. Ye Q, Ling S, Zheng S, Xu X. Biopsi cecair dalam hepatoselular
karsinoma: sel tumor yang beredar dan DNA tumor yang beredar.Kanser Mol.2019;18: 114.
49. Zhang Y, Yao Y, Xu Y, Li L, Gong Y, Zhang K, et al.Kanser pancutan
pengesanan DNA tumor yang beredar di lebih 10,000 pesakit China.Nat Commun.2021;12: 11.
50. Eisenhauer EA, Therasse P, BogaertsJ, Schwartz LH, Sargent D, Ford R, et al.Kriteria penilaian tindak balas baharu dalam tumor pepejal: garis panduan RECIST yang disemak semula (versi 1.1).Kanser Eur J.2009;45: 228-47.
51. LitièreS, Collette S, de Vries EG, Seymour L, BogaertsJ.RECIST - belajar dari masa lalu untuk membina masa depan.Nat Rev Clin Oncol.
2017;14: 187-92.
52. Seymour L, BogaertsJ, Perrone A, FordR, Schwartz LH, Mandrekar S, et al.iRECIST: garis panduan untuk kriteria tindak balas untuk digunakan dalam percubaan
menguji immunotherapeutics.Lancet Oncol.2017;18: e143-52.
53. PantelK, Alix-Panabières C. Biopsi cecair dan sisa penyakit yang minimum – kemajuan terkini dan implikasi untuk penyembuhan.Nat Rev Clin Oncol.2019;16: 409-24.
Petik artikel ini sebagai: Qian C, Zou X, Li W, Li Y, Yu W. Pos luar menentang kanser: penanda kanser sejagat sahaja.Kanser Biol Med.2023;20: 806-815.
doi: 10.20892/j.issn.2095-3941.2023.0313
Masa siaran: Mei-07-2024